The role of the carbon monoxide-producing enzyme heme-oxygenase 1 in the immunogenicity of dendritic cells
2015
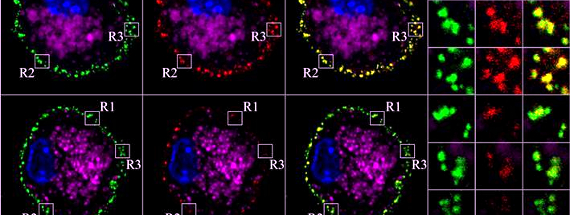
El Monóxido de Carbono (CO) ha sido recientemente reportado como el principal mediador anti-inflamatorio de la enzima Hemo-Oxigenasa 1 (HO-1). Ya sea la sobre-expresión de HO-1 o el tratamiento de animales con CO, reduce patologías inflamatorias tales como rechazo a trasplantes y sepsis, así como la severidad de enfermedades autoinmunes. Sin embargo, los mecanismos celulares por los cuales el eje HO-1/CO reduce estas patologías no han sido demostrados, como tampoco su efecto en infecciones bacterianas.
En este estudio se observó que este eje interfiere con la capacidad de células mieloides para responder a moléculas pro-inflamatorias presentes en bacterias, como el lipopolisacárido bacteriano (LPS), por medio de la reducción de la expresión del complejo TLR4/MD2. Este fenómeno previene el shock séptico mediado por LPS bacteriano en ratones. Además, HO-1 fue capaz de regular la expresión del receptor de inmunolgobulinas FcγRIII, el cual cumple un rol fundamental en la captura y procesamiento de patógenos recubiertos por IgG, tales como Streptococcus pneumoniae. Más aún, se determinó que este mismo eje reduce la presentación de antígenos solubles y bacterianos en células dendríticas (DCs), al interferir una vía de maduración endosomal dependiente de la función mitocondrial. Este proceso redujo la activación de linfocitos T vírgenes y también protegió frente al desarrollo de diabetes tipo 1 en un modelo murino. Se observó además que la sola desestabilización mitocondrial, usando el conocido desacoplante mitocondrial CCCP, también redujo la presentación de antígenos previniendo así el desarrollo de diabetes tipo 1, sin afectar la viabilidad celular.
Esto sugiere que futuras terapias deberían considerar la función mitocondrial como blanco de regulación para prevenir patologías inmunes mediadas por DCs y linfocitos T. De la misma manera, la función de este organelo podría ser potenciada para potenciar la eficacia de vacunas contra patógenos bacterianos. En conclusión, los resultados de este estudio sugieren que el eje HO-1/CO regula la respuesta inmune por medio de la reducción de receptores requeridos para reconocer moléculas pro-inflamatorias presentes en bacterias y además por medio de la reducción de la función mitocondrial y la reducción de la presentación antigénica.

- Nombre: Sebastián Riquelme Colet
- Laboratorio: Patogénesis Microbiana
- Mención: Genética Molecular y Microbiología
- Director Tesis: Susan Bueno
Artículos Publicados
1. Sebastián A. Riquelme, Juan Pablo Macker-Oberti, Susan M. Bueno and Alexis M. Kalergis. Modulation of antigen presentation by Heme-oxygenase 1 and its implications for reducing detrimental inflammation. (In preparation)
2. Riquelme SA, Pogu J, Anegon I, Bueno SM and Kalergis AM. (2015) Carbon Monoxide Impairs Mitochondria-dependent Endosomal Maturation and Antigen Presentation in Dendritic Cells. Eur J Immunol. 45(12): 3269-88. doi: 10.1002/eji.201545671.
3. Riquelme SA, Bueno SM and Kalergis AM. (2015) Carbon monoxide down-modulates TLR4/MD2 expression on innate immune cells and reduces endotoxic shock susceptibility. Immunology. 144(2): 321-32. doi: 10.1111/imm.12375.
4. Martel SI*, Riquelme SA*, Bozinovic F and Kalergis AM. (2014) Dietary effect on immunological energetics in mice. J Comp Physiol B. 184(7): 937-44. doi: 10.1007/s00360-014-0852-x. Epub 2014 Aug 17.
5. Céspedes PF, Bueno SM, Ramírez BA, Gomez RS, Riquelme SA, Palavecino CE, Mackern-Oberti JP, Mora JE, Depoil D, Sacristán C, Cammer M, Creneguy A, Nguyen TH, Riedel CA, Dustin ML, Kalergis AM. (2014) Surface expression of the hRSV nucleoprotein impairs immunological synapse formation with T cells. Proc Natl Acad Sci U S A. 111(31): E3214-23. doi: 10.1073/pnas.1400760111.
6. Mackern-Oberti JP, Riquelme SA, Llanos C, Schmidt CB, Simon T, Anegon I, Jara E, Riedel CA, Bueno SM, Kalergis AM. (2014) Heme Oxygenase-1 as a Target for the Design of Gene and Pharmaceutical Therapies for Autoimmune Diseases. Curr Gene Ther. 14(3): 218-35.
7. Tittarelli A, Mendoza-Naranjo A, Farías M, Guerrero I, Ihara F, Wennerberg E, Riquelme SA, Gleisner A, Kalergis A, Lundqvist A, López MN, Chambers BJ, Salazar-Onfray F. (2014) Gap junction intercellular communications regulate NK cell activation and modulate NK cytotoxic capacity. J Immunol. 192(3): 1313-9. doi: 10.4049/jimmunol.1301297.
8. Tardif V*, Riquelme SA*, Remy S, Carreño LJ, Cortés CM, Simon T, Hill M, Louvet C, Riedel CA, Blancou P, Bach JM, Chauveau C, Bueno SM, Anegon I, Kalergis AM. (2013) Carbon monoxide decreases endosome-lysosome fusion and inhibits soluble antigen presentation by dendritic cells to T cells. Eur J Immunol. 43(11): 2832-44. doi: 10.1002/eji.201343600.
9. Mackern-Oberti JP, Llanos C, Carreño LJ, Riquelme SA, Jacobelli SH, Anegon I, Kalergis AM. (2013) Carbon monoxide exposure improves immune function in lupus-prone mice. Immunology. 140(1): 123-32. doi: 10.1111/imm.12124.
10. Espinoza JA, Bohmwald K, Céspedes PF, Gómez RS, Riquelme SA, Cortés CM, Valenzuela JA, Sandoval RA, Pancetti FC, Bueno SM, Riedel CA, Kalergis AM. (2013) Impaired learning resulting from respiratory syncytial virus infection. Proc Natl Acad Sci U S A. 110(22):9112-7. doi: 10.1073/pnas.1217508110.
11. Nieto PA, Riquelme SA, Riedel CA, Kalergis AM, Bueno SM. (2013) Gene elements that regulate Streptococcus pneumoniae virulence and immunity evasion. Curr Gene Ther. 13(1): 51-64.
12. Bueno SM, Riquelme SA, Riedel CA, Kalergis AM. (2012) Mechanisms used by virulent Salmonella to impair dendritic cell function and evade adaptive immunity. Immunology. 137(1): 28-36. doi: 10.1111/j.1365-2567.2012.03614.x.
13. Riquelme SA, Bueno SM, Kalergis AM. (2012) IgG keeps virulent Salmonella from evading dendritic cell uptake. Immunology. 136(3):291-305. doi: 10.1111/j.1365-2567.2012.03578.x.
